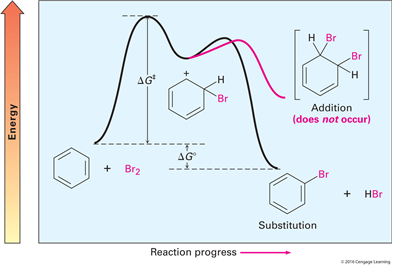
친전자체는 방향족 고리와 반응하여 고리 위의 한 개의 수소를 치환한다. Benzene의 친전자성 브로민화 반응 첨가반응이 일어날 경우, 방향족 고리의 안정화 에너지인 150KJ을 잃고 자유에너지는 증가한다. 치환반응이 일어날 경우 에너지는 잃지 않으나 자유에너지는 감소한다. Friedel-Crafts 반응 Benzene 고리 위에 알킬기를 도입하는 반응이다. Friedel-Crafts 반응의 4가지 한계 1. 할로젠화 알킬만 사용가능하다. (F, Cl, I, Br) -방향족 및 할로젠화 바이닐은 높은 에너지 준위를 가져 Friedel-Crafts 반응과 적합하지 않다. 2. EWG(전자 끄는기), 염기성 아미노기(-NH2) 를 포함하는 고리는 Friedel-Crafts 반응이 진행 되지 않는다. - EW..