화학적 이동
서로 다른 핵을 둘러싸고 있는 전자들의 작은 국부적 자기장이 원인.
전자에 의해서 강하게 가려진 핵을 공명시키기 위해서는 더 높은 외부 자기장을 필요로 하며,
NMR 도모지의 오른쪽에서 흡수가 일어난다.
약하게 가려진 핵을 공명 시키기 위해서는 낮은 외부 자기장이 필요하고, NMR 도모지의 왼쪽에서 흡수가 일어난다.
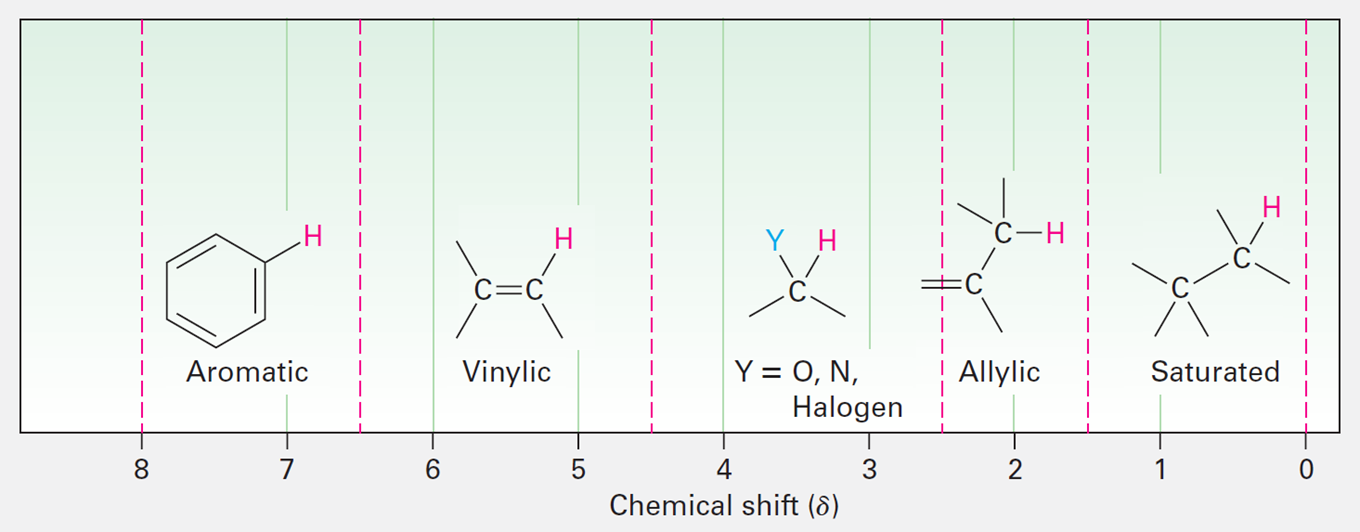
일반적으로 포화된 sp3 혼성 탄소에 결합된 양성자는 높은 장에서 흡수가 일어나고,
반면 sp2 혼성 탄소에 결합된 양성자는 낮은 장에서 흡수가 일어난다.
N, O 또는 할로젠과 같이 전기 음성적인 원자에 결합된 탄소의 양성자 역시 낮은 장에서 흡수가 일어난다.
1H 양성자 수 계산
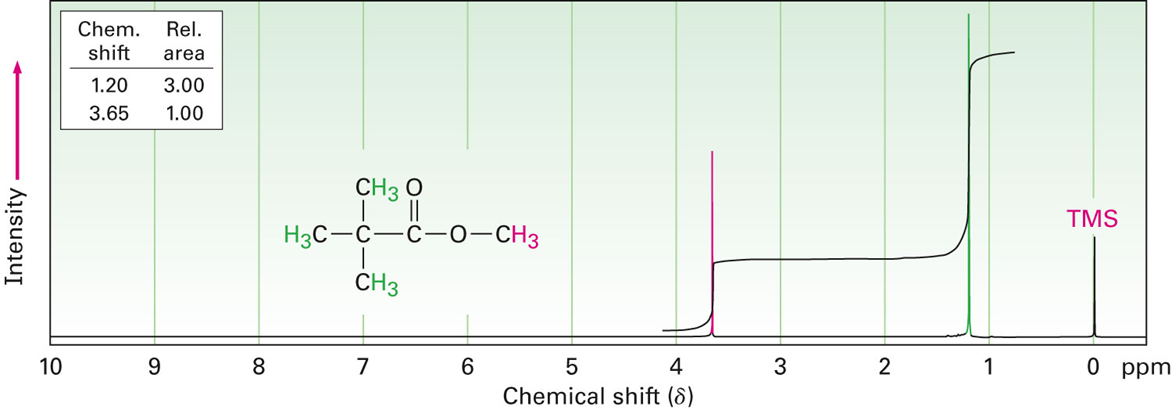
피크 아래의 면적은 그 피크가 나타내는 양성자의 수에 비례한다.
피크 아래의 면적을 전자적으로 측정, 또는 적분하여 분자 내 서로 다른 종류의 양성자의 상대비를 알 수 있다.
위 분자는 -CH3와 -OCH3 두 개의 피크를 찾을 수 있는데,
-CH3의 양성자 수는 9개, -OCH3는 3개로 3:1의 상대비를 가진다.
-CH3는 전자 밀도가 높기 때문에 도모지의 우측에 배치될것이고, -OCH3는 O에 전자를 빼앗겨 전자 밀도가
낮으므로 도모지의 좌측에 배치된 것을 볼 수 있다.
스핀-스핀 갈라짐
1H NMR 스펙트럼에서는 단일 피크가 아닌 한 양성자의 흡수가 다중선(multiplet)이라 칭하는
여러 개의 피크로 나타내는 경우가 나타난다.

위 그림 과 같이 -CH3CH2Br 과 같은 분자를 NMR 로 나타내었을 때,
다음과 같은 스핀-스핀 갈라짐(spin-spin splitting)이라고 부르는 다중 흡수 현상을 볼 수 있다.
이는 바로 옆 이웃한 핵 스핀 간의 상호작용, 또는 짝지음에 의한 것이다.
위 그래프를 보았을 때, -CH3는 파란색 그래프를 나타내는데, 세 개의 선을 가지고 있는데,
이는 바로 옆에 존재하는 -CH2의 영향을 받기 때문이라는 것이다.
이와 같은 원리로 -CH2Br는 네 개의 사중선을 지닌다.
이를 n+1 규칙이라고 부른다.
NMR 스펙트럼에서 n개의 동등한 양성자를 이웃한 양성자들은 n+1 개의 피크를 가진다.

-CHBr의 양 옆에 존재하는 두 개의 -CH3는 서로 동등한 양성자를 가지고 있으며,
-CHBr과 이웃해 있기 때문에 같은 피크를 지닌다
-CHBr는 하나의 양성자를 지니고 있기 때문에 -CH3는 (1+1=2) 두개의 피크를 지녀 이중선을 지니게 된다.
그와 동일하게 -CHBr은 세 개의 양성자를 가진 두 개의 동등한 -CH3와 이웃해 있기 때문에
(6+1=7) 로 일곱 개의 피크를 지녀 칠중선을 지니게 된다.
짝지음 상수
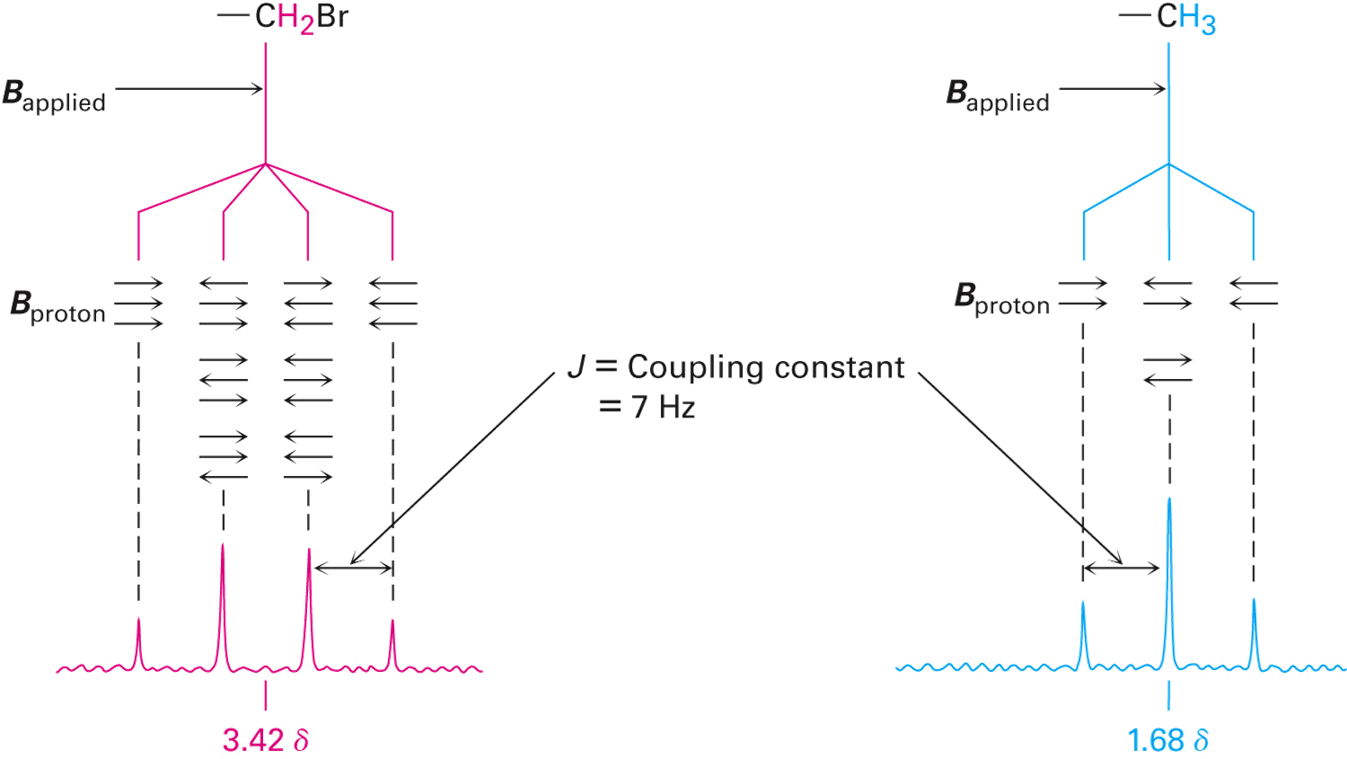
CH3CHBrCH3 에서도 -CH3와 -CHBr은 피크 개수가 다르나, 선 사이 파장의 길이는 동일하다.
그러므로, 짝지음 상수가 동일할 경우 서로 붙어 있다는 해석이 가능하다.
'화학' 카테고리의 다른 글
| Benzene의 안정성 (0) | 2022.09.28 |
|---|---|
| 콘쥬게이션 다이엔(Conjugation Diene) (0) | 2022.09.27 |
| 산과 염기 (0) | 2022.09.19 |
| 오비탈과 전자 배치 (2) | 2022.09.13 |
| 형식 전하 (0) | 2022.09.05 |