친전자체는 방향족 고리와 반응하여 고리 위의 한 개의 수소를 치환한다.
Benzene의 친전자성 브로민화 반응
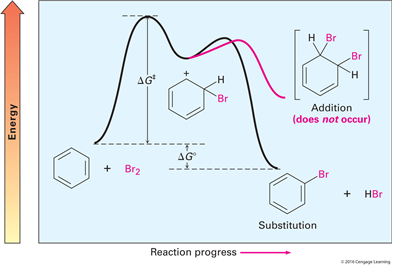
첨가반응이 일어날 경우, 방향족 고리의 안정화 에너지인 150KJ을 잃고 자유에너지는 증가한다.
치환반응이 일어날 경우 에너지는 잃지 않으나 자유에너지는 감소한다.
Friedel-Crafts 반응
Benzene 고리 위에 알킬기를 도입하는 반응이다.

Friedel-Crafts 반응의 4가지 한계
1. 할로젠화 알킬만 사용가능하다. (F, Cl, I, Br)
-방향족 및 할로젠화 바이닐은 높은 에너지 준위를 가져 Friedel-Crafts 반응과 적합하지 않다.
2. EWG(전자 끄는기), 염기성 아미노기(-NH2) 를 포함하는 고리는 Friedel-Crafts 반응이 진행 되지 않는다.
- EWG는 생략하고, 염기성 아미노기를 사용하게 되면, 촉매로 사용되는 AlCl3와 반응하게 되어
염기성 아미노기는 루이스 염기로, 촉매는 루이스 산의 역할을 하게 된다.

3. 단일 치환이 아닌 다중 치환 현상이 발생한다.

4. 탄소 양이온 치환체의 안정화를 위한 친전자체의 골격 자리옮김 현상.

아실화(Acylation)
방향족 고리와 AlCl3의 존재 하에 카복시산염화물과의반응으로
아실기 치환반응을 일으킨다.
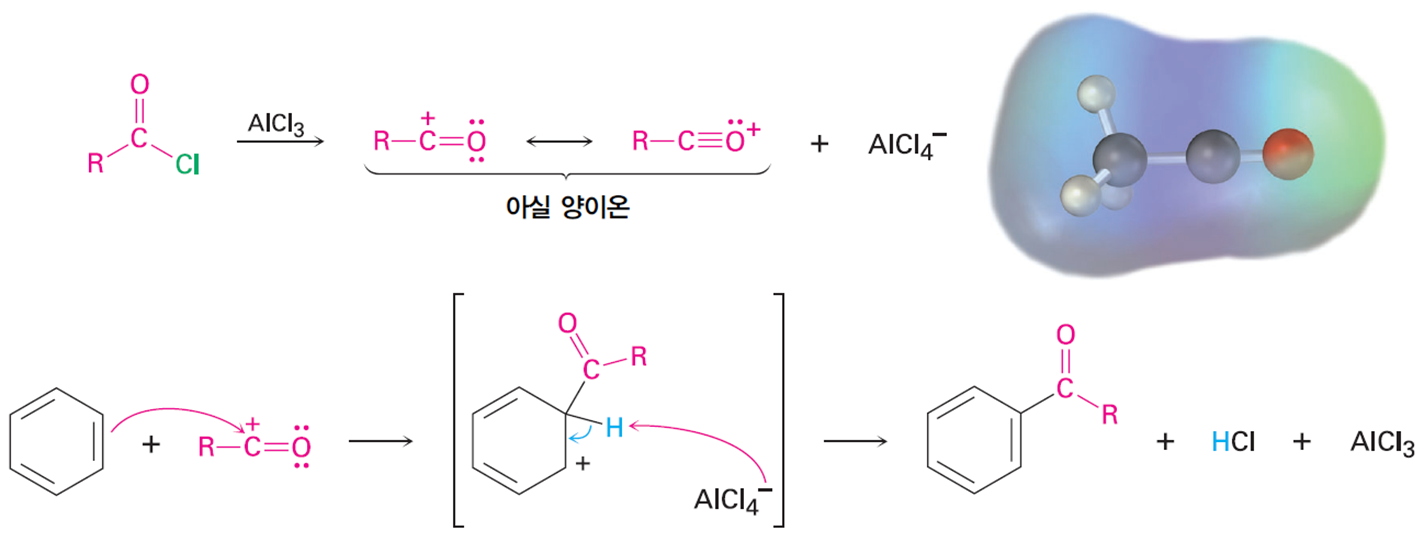
아실화의 이점
1. 아실화는 공명구조로 인해 안정화 되어 있는 탄소의 비어있는 p오비탈과 인접한
산소의 고립 전자쌍들로 인해 자리옮김 반응이 일어나지 않는다.
2. 아실화 반응은 생성물은 acylbenzene이 출발 물질보다 항상 반응성이 낮기 때문에
다중 치환이 일어나지 않는다.
치환기 효과
특정 치환기에 따라 친전자성 치환반응은 영향을 받는다.
1. 치환기는 방향족 고리의 반응성에 영향을 준다.
2. 치환기는 반응의 배향성에 영향을 준다.

-NO2 같은 EWG(전자 끄는기) 는 메타를 지향하며 주로 활성감소 역할을 한다.
-X 의 할로젠은 오쏘-파라를 지향하나 약한 활성감소역할을 한다.
-OH 같은 EDG(전자 미는기) 는 오쏘-파라를 지향하며 활성화 역할을 한다.
-OH기는 전기음성도가 높은데 왜 EDG에 해당하는가?
-OH기의 비공유 전자쌍은 고리와 공명구조를 형성할 수 있다.
공명구조는 전자 풍부 및 비편재화의 역할을 하기에
유발효과에 의한전자 끄는기보다
공명으로 인한 전자 미는기의 힘이 더 강해 EDG에 해당한다.
활성화기의 역할
방향족 고리에 전자를 공급한다.
-고리는 전자가 풍부해진다.
-탄소양이온 중간체는 안정화된다.
-활성화 에너지가 낮아진다.
활성감소기의 역할
-고리는 전자가 부족해진다.
-탄소양이온 중간체는 불안정해진다.
-활성화 에너지가 증가한다.
'화학' 카테고리의 다른 글
| 에터 - Williamson 에터 합성법 (0) | 2022.11.15 |
|---|---|
| 알코올와 페놀 (0) | 2022.11.13 |
| 방향족, 명명법 (aromatic) (0) | 2022.10.03 |
| Benzene의 안정성 (0) | 2022.09.28 |
| 콘쥬게이션 다이엔(Conjugation Diene) (0) | 2022.09.27 |