오비탈은 쉽게 말해 하나의 전자가 가장 가능성이 높게 차지하고 있음직한 핵 주위 공간의 부피를 말한다.
원자의 양자역학적 모형에 의하면, 유체 속의 파동을 수학적으로 계산하는 파동 방정식의 해를 파동 함수 또는
오비탈(orbital)이라고 한다.
오비탈의 전자구름은 뚜렷한 경계선을 가지고 있지는 않으나, 실질적인 존재위치, 전자가 대부분 머무르게 되는
공간의 한계점을 정할 수 있다.
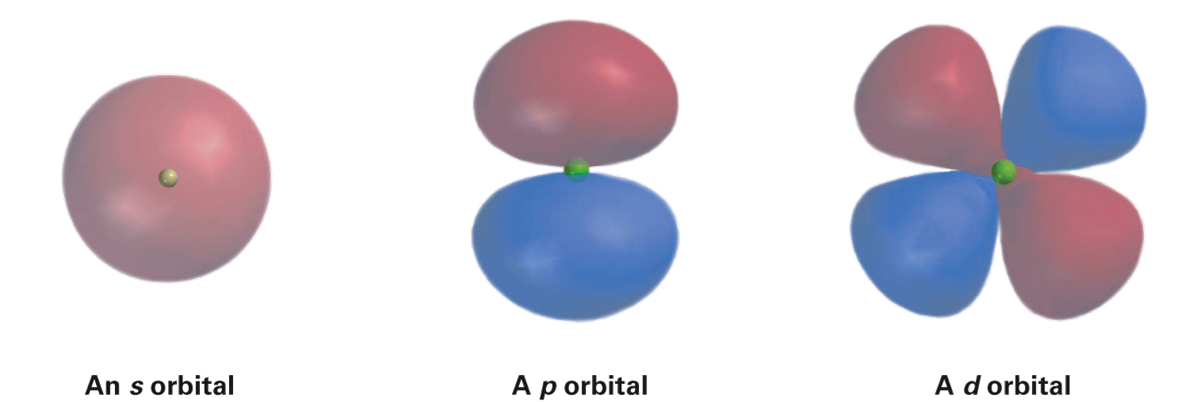
오비탈은 s, p, d, f 로 표시하며, 각각 다른 모양을 하는 네 종류가 존재한다.
s 오비탈은 중앙에 핵이 존재하는 구 형태를 띄고 있고, p 오비탈은 아령 모양, d 오비탈은 다섯 개가 존재하는데,
네 개는 클로버 모양을 띄고 있고, 나머지 한 개는 늘어난 아령의 가운데 부분을 도넛이 감싸고 있는 모양이다.
한 원자의 오비탈은 순차적으로 점점 큰 크기와 에너지를 가지는 전자 껍질(electron shell)을 지닌다.
다른 껍질은 다른 수와 종류의 오비탈을 가지며, 하나의 껍질 안에 있는 오비탈은 두 개 의 전자가 채워질 수 있다.

아래 설명
첫 번째 껍질은 1s 로 하나의 s 오비탈만 가지고 있어 두 개의 전자만을 가진다.
두 번째 껍질은 하나의 2s 오비탈과 세 개의 2p 오비탈을 가지고 있어 총 8개의 전자를 가진다.
세 번째 껍질은 하나의 3s 오비탈과 세 개의 3p 오비탈, 다섯 개의 3d 오비탈을 가져 총 18개의 전자를 가질 수 있다.
( 여기서 표시하진 않았으나 네 번째 껍질의 첫 번째 오비탈인 4s 오비탈의 에너지 준위는 3p와 3d 사이에 존재한다.)
주어진 껍질 속에 세 개의 다른 p오비탈은 서로 다른 두 개의 오비탈에 대해 수직으로 공간 배향을 한다.
p오비탈은 기준 축에 따라 px, py, pz로 나타낸다.

바닥 상태 전자 배치(ground state electronic configuration)는 해당 원자의 전자들에 의해 채워지는 오비탈에 대한 배열을 말한다.
이 배열은 세 가지 규칙에 의해 결정된다.
1. 1s→ 2s→ 2p→ 3s→ 3p→ 4s→ 3d 순서에 따라 가장 낮은 에너지 오비탈로부터 먼저 채워져야 한다.
2. 스핀은 위 (↑) 와 아래(↓)로 표시되는 두 가지 배향을 가질 수 있다. 한 오비탈에는 두 개의 전자만 채울 수 있으며,
두 개의 전자는 서로 반대 방향을 띄고 있어야한다. (파울리 배타 원리에서 배웠을 것이다.)
3. 에너지가 동일한 두 개 또는 그 이상 비어있는 오비탈이 존재한다면, 모든 오비탈이 반 씩 채워질 때 까지는 각 오비탈 마다 같은 스핀을 가진 한 개씩의 전자만을 채운다. (훈트 법칙)
(세 오비탈에 세 개의 전자를 채운다고 할때, 한 개의 오비탈을 다 채우고 두 번째 오비탈에 한개를 채우는게 아닌,
세 개의 오비탈에 위를 향하는 스핀을 한 개씩을 채워 넣는 것이다.)


좌- 1번 우- 2, 3번
EX) 황 (Sulfate) 의 바닥 상태 전자 배치

'화학' 카테고리의 다른 글
| NMR 분광법 - 화학적 이동, 양성자 수 계산, 다중선 (0) | 2022.09.27 |
|---|---|
| 산과 염기 (0) | 2022.09.19 |
| 형식 전하 (0) | 2022.09.05 |
| 극성 공유 결합- 전기 음성도(유발효과) (0) | 2022.09.05 |
| NMR 분광법 (0) | 2022.09.02 |